同学们,初中化学学习中,化合价口诀一定是人人绕不开的一个坎儿。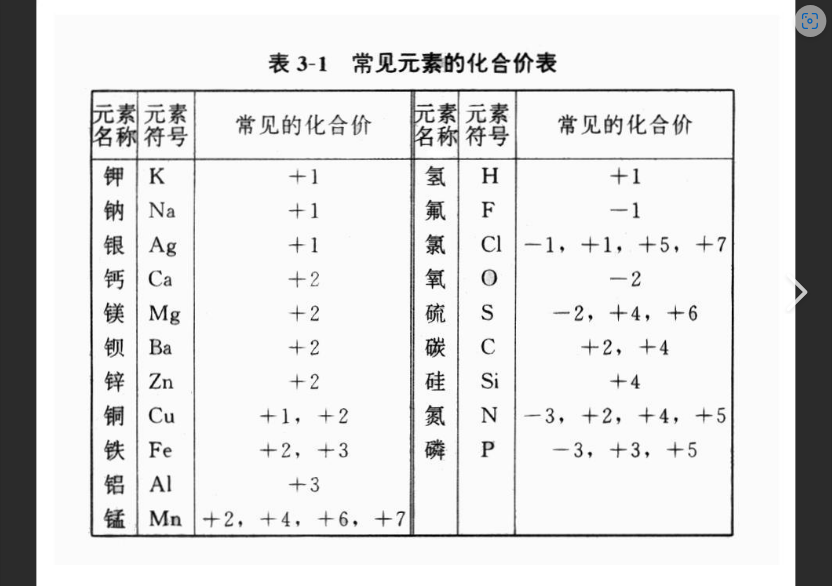
“一价氢氯钾钠银,二价氧钙钡镁锌,三铝四硅五价磷…” 相信不少同学都背得滚瓜烂熟。没错,化合价口诀在入门阶段,确实能赞助我们快速判断一些常见物质的化学式,解决一些简单的化学计算问题。然则!仅仅依靠口诀,真的就能学好化学了吗?
化合价口诀的局限性:救急可以,深入理解弗成!
化合价口诀就像一本“速查手册”,告诉我们一些元素常见的化合价。但它并不克不及解释为什么这些元素会有这样的化合价。好比,为什么氢通常显+1价,而氧通常显-2价?为什么有些元素有多种化合价,例如铁有+2和+3价?仅仅依靠口诀,我们无法理解这些实质原因,遇到稍微复杂一点的问题,就容易卡壳,甚至涌现毛病。
而且,口诀只能记住有限的元素和化合价,面对新型化合物或者不常见的元素,口诀就完全失效了。更重要的是,死记硬背口诀容易让我们陷入“知其然而不知其所以然”的困境,晦气于培养真正的化学思维。
“原子结构”秘籍:理解化学的钥匙!
那么,有没有一种方法,能够让我们更深入地理解化合价,甚至预测未知元素的化合价呢?谜底是肯定的!这个“秘籍”就是原子结构!
原子结构是构成物质的最基本单位——原子的内部构造。虽然初中化学不会深入讲解复杂的量子力学知识,但我们需要掌握原子结构的基本概念,好比:原子由原子核和核外电子构成;原子核带正电,核外电子带负电;电子在原子核外特定的区域(电子层)运动。
原子结构与元素性质:最外层电子数决定一切!
原子结构中最关键的概念之一就是最外层电子数。元素的化学性质,特别是它的化合价,几乎完全取决于其最外层电子数。简单来说,原子都希望到达一个稳定的状态,就像贵族气体(氦、氖、氩等)那样,最外层电子数为8(氦为2)——这就是所谓的稳定结构。
为了到达稳定结构,原子会通过得失电子或者共享电子的方式与其他原子结合,形成化学键。而得失电子的数目,就决定了该元素在化合物中表示出的化合价。
原子结构与化合价:实例分析,融会贯通!
让我们以水(H₂O)为例,分析一下原子结构与化合价的关系。
因此,一个氧原子需要与两个氢原子结合,每个氢原子提供1个电子,氧原子得到2个电子,形成稳定的水分子。在这个过程中,氢原子失去1个电子,显+1价;氧原子得到2个电子,显-2价。
通过这样的分析,我们就能理解为什么水是H₂O,而不是HO或者H₃O。同时,我们也明白了化合价的实质,不再是死记硬背的符号,而是原子之间电子转移的结果。
变价元素的秘密:不止一种可能!
有些元素,好比铁(Fe),有+2和+3两种化合价。这是因为铁原子失去分歧数量的电子,可以形成分歧的稳定结构。这涉及到更复杂的电子排布知识,初中阶段只需要知道,有些元素可以有多种化合价,具体是哪种,需要根据具体的化学环境来判断。
拥抱原子结构,开启化学新世界!
同学们,化合价口诀只是学习化学的敲门砖,而原子结构才是真正理解化学的钥匙。掌握原子结构的基本知识,能够赞助我们更好地理解元素性质、化合价、化学反应的实质。不要再满足于死记硬背口诀,勇敢地探索原子结构的奥秘,你会发现,化学原来如此有趣!
从现在开始,试着用原子结构的视角来分析你学过的化学物质,你会发现,化学世界的大门正为你敞开!记住,理解才是学习的最高境界!